研究目的
難治性血液腫瘍疾患である白血病の病因として、白血病幹細胞の異常増殖のみならず骨髄微少環境(幹細胞ニッチ)を構成するストローマ細胞・血管内皮細胞の活性化や免疫監視機構(T細胞、マクロファージ)の破綻が重要である。本研究では、M-bcr/abl遺伝子発現白血病マウスモデルにおいて、腫瘍細胞、ニッチ細胞、免疫細胞を選択的に採取し、それらの形質膜ミクロドメインにおけるスフィンゴ脂質分子種(炭素鎖、2重結合、メチル化などの差異)の解析を実施する。病態/病因に関連するスフィンゴ脂質(セラミド、スフィンゴミエリン)分子を特定した後、その生合成に関わるスフィンゴミエリン合成酵素などのスフィンゴ脂質代謝合成酵素を制御する事で膜ミクロドメイン機能を正常化し、膜貫通型増殖シグナルの異常を制御する。白血病細胞、ストローマ細胞、免疫細胞の細胞内シグナル活性化と生体での動態をリアルタイムに検証し、スフィンゴ脂質制御が白血病幹細胞増殖抑制のためのエピジェネティックな分子ターゲットであることを明らかにする。即ち、膜ミクロドメインにおけるスフィンゴ脂質の分子種とその分布の異常を量的ならびに分子種的に正常化することが白血病に対する進行の抑制と治療後再発の阻止のための新規先制治療法となり得る事を明らかにする。
これまでの研究背景
脂質は、これまで細胞内と細胞外を分ける細胞膜の構成成分として永らく考えられ、均一な脂質二重膜にタンパク質(主にシグナル関連受容体)が浮かんでいる形態がシンガーニコルソンらにより提唱されていた。ところが、近年、この形質膜モデルは実際の状況とは異なることが次第に明らかになってきた。即ち、細胞膜二重層では外膜と内膜での脂質分布が異なること(垂直方向の不均一性)、細胞膜に脂質ラフトまたは脂質ミクロドメインと呼ばれる島状の脂質分布の偏り(水平方向の不均一性)が存在し、脂質の多様性が膜受容体の機能を制御することが判明した。特に、スフィンゴ脂質(セラミド、スフィンゴミエリン,GM3など)が細胞膜ミクロドメインの形成や維持に重要な役割を果たすことが、申請者らのグループを中心に精力的に研究され、スフィンゴ脂質ミクロドメインは細胞膜貫通型の受容体のシグナル伝達を制御する足場(プラットフォーム)の役割として機能することが報告された(Cell 6;77(3):325-8. 1994, J. Biol. Chem., 2011)。腫瘍性疾患において、細胞外からの増殖刺激(out-inシグナル)に対する反応異常がその病因・病態の基礎となっている。即ち、スフィンゴ脂質分子の変化(例えばスフィンゴミエリン合成酵素(SMS)によるセラミド⇄スフィンゴミエリンの相互変換)による細胞膜ミクロドメイン構造変化が細胞外刺激による細胞増殖シグナルを機能的に制御することが示唆される。腫瘍性疾患に場合には、細胞増殖性サイトカインが受容体を介して異常増殖を亢進させるが、この反応をout-inシグナルの伝達足場であるスフィンゴ脂質膜ミクロドメイン制御によって抑制することが可能であることが想定される。このことは、従来型の遺伝子異常の制御(“DNAワールド制御”)ではなく、多様なスフィンゴ脂質群を介したミクロドメイン制御(“スフィンゴ脂質ワールド制御”)によるエピジェネティックな細胞増殖抑制が難治性血液腫瘍である白血病の治療として有用であることを強く示唆する。
岡崎らは、それまでは細胞膜構造成分として考えられていたセラミドが白血病細胞で細胞分化、細胞死を誘導する機能性脂質あることを初めて報告し(J. Biol. Chem., 264: 19076-19080, 1989)、スフィンゴ脂質が新たな抗ガン剤開発の分子標的になることを明らかにした。さらに、セラミドと既知の化学療法剤との併用が細胞死誘導シグナルを増強する事で白血病細胞の抗ガン剤耐性克服に有用であること、難治性白血病患者由来芽球ではセラミド産生機構の抑制と代謝機構の亢進が同時に惹起され、細胞内セラミド量が増加できない機構が抗ガン剤耐性化と緊密に関係することを報告した(Sphingolipid Biology, 2006、 Clin. Cancer Res., 2003)。申請者らは、セラミドの細胞死誘導分子機構として、その下流シグナルとして活性酸素増加、カスペース活性化やPI3キナーゼ抑制などが関与することを明らかにした(J. Biol. Chem.1989、Cell Death Diff. 2010)。
一方、申請者らは、セラミドよりスフィンゴミエリンを産生する責任酵素であるスフィンゴミエリン産生酵素(SMS)を初めて遺伝子クローニングした(J. Biol. Chem., 2004)。スフィンゴミエリンはコレステロールとともに細胞膜のミクロドメイン構成の必須分子であり、種々の膜貫通型受容体機能を制御する。実際、スフィンゴミエリンはクラスリン関連ドメインでのトランスフェリン(Tf)受容体の取り込み機構を活性化し、Tfによる細胞増殖を亢進した(J. Biol. Chem., 2011)。また、申請者らはSMSを介したスフィンゴミエリンやセラミドによる膜ミクロドメインの機能制御が細胞死誘導のみならず白血病細胞の遊走能も調節することを明らかにし、白血病細胞の生体内での浸潤・転移にもスフィンゴ脂質ミクロドメインが関与することを示した(Molecular and Cell Biology, 2012、 J. Biol. Chem. jbc.M112.416552)。
実験計画
近年、血液腫瘍細胞の増殖には、腫瘍細胞自身の増殖のみならず、骨髄での腫瘍増殖促進環境(ニッチ)の活性化や、腫瘍免疫を司るT 細胞や炎症性マクロファージの積極的な意義が報告されているが、脂質による膜ミクロドメイン機能制御の観点から、細胞増殖とその環境を統一的に研究する試みはまだない。従って、本研究では、まず(1)白血病における細胞増殖の原因を細胞膜ミクロドメインの機能異常としてとらえて、M−bcr/abl過剰発現白血病マウスモデルで、腫瘍細胞のみならず骨髄ニッチ細胞や腫瘍免疫細胞において膜ミクロドメイン構成分子であるスフィンゴ脂質の分子種(脂肪酸の炭素鎖長の違いやメチル化など)とその量的変化について、セル・ソーターと脂質質量分析(LC/MS/MS)法を駆使して細胞選択的にスフィンゴ脂質分子種解析(選択的スフィンゴリピドーム)を実施する。次に、(2)同定された膜ミクロドメインを制御するスフィンゴ脂質分子種の調節によって腫瘍細胞、ニッチ細胞、免疫担当細胞の活性化や移動が制御されることを、白血病マウスモデルで腫瘍細胞内シグナル経路や細胞接着・浸潤について2光子レーザー顕微鏡を用いてリアルタイムに解析する。その結果として、(3)細胞外増殖刺激シグナルが膜ミクロドメインを介して下流シグナルを活性化する過程をスフィンゴ脂質が制御することをリアルタイムイメージとして証明し、(4)白血病治療のエピジェネティックな分子ターゲットとしてスフィンゴ脂質分子が重要で有用である確証を得る。
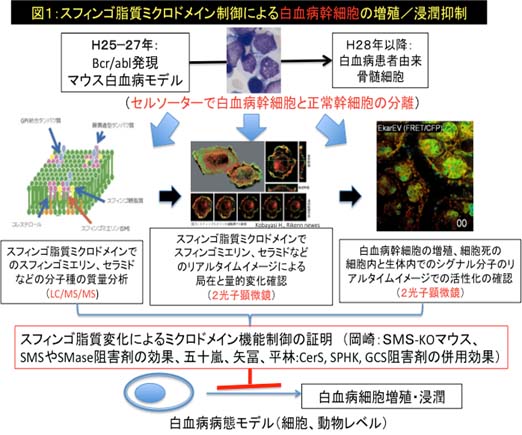
即ち、本研究は従来型研究のように膜脂質分析を網羅的、無目的に試行する単純なリピドミクス研究ではなく、白血病幹細胞とその増殖支持細胞群の膜ミクロドメインにおけるスフィンゴ脂質の分子種の解析を行い、スフィンゴ脂質の細胞機能制御作用をリアルタイムに動物モデルで明らかにする世界的に類を見ない研究である。最終的には、日本で “スフィンゴ脂質ワールド制御”研究に基づくエピジェネティックな革新的白血病治療法を開発する事を目指す。
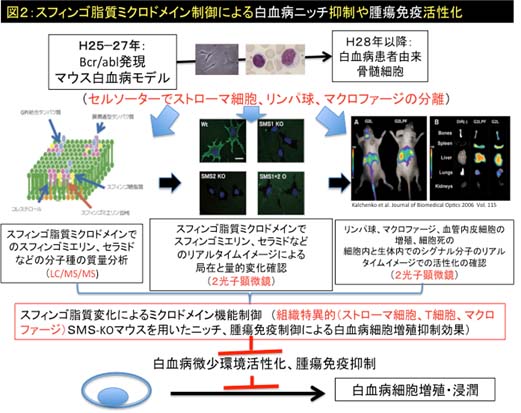
 即ち、本研究は従来型研究のように膜脂質分析を網羅的、無目的に試行する単純なリピドミクス研究ではなく、白血病幹細胞とその増殖支持細胞群の膜ミクロドメインにおけるスフィンゴ脂質の分子種の解析を行い、スフィンゴ脂質の細胞機能制御作用をリアルタイムに動物モデルで明らかにする世界的に類を見ない研究である。最終的には、日本で “スフィンゴ脂質ワールド制御”研究に基づくエピジェネティックな革新的白血病治療法を開発する事を目指す。
即ち、本研究は従来型研究のように膜脂質分析を網羅的、無目的に試行する単純なリピドミクス研究ではなく、白血病幹細胞とその増殖支持細胞群の膜ミクロドメインにおけるスフィンゴ脂質の分子種の解析を行い、スフィンゴ脂質の細胞機能制御作用をリアルタイムに動物モデルで明らかにする世界的に類を見ない研究である。最終的には、日本で “スフィンゴ脂質ワールド制御”研究に基づくエピジェネティックな革新的白血病治療法を開発する事を目指す。

